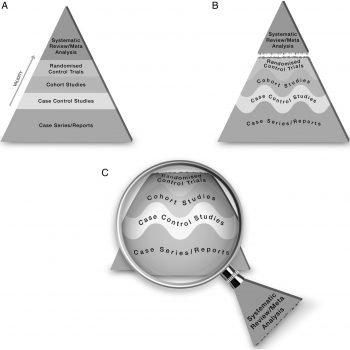
Misurare l’impatto di una pubblicazione scientifica
Lo strumento più utilizzato per conoscere il valore di una pubblicazione scientifica è la misura dell’impact factor (IF), che consiste nel calcolare il numero medio di citazioni ricevute dagli articoli pubblicati su una certa rivista. Sebbene l’IF sia …